名古屋大学大学院理学研究科の博士課程1年の伏原大地と申します。研究分野は核酸化学で、主に核酸を用いた医薬品の研究をしています。
核酸というだけでピンとくる人はいるでしょうか?後ほど詳しく紹介しますが、ざっくりと言ってしまうと核酸はヒトの設計図にあたるものです。
本記事では、私の研究である「ヒトの設計図を使って薬をつくる」という事をテーマとして紹介していきたいと思います。
目次
ヒトの設計図
設計図というと皆さんはどういったものを想像するでしょうか?
紙に書かれた図面やUSBメモリーに入った3Dデータを想像するかもしれません。
では、ヒトの設計図は?
簡単に言ってしまうと、極小のひもです。
もちろん、ただのひもではありません。この紐こそが、核酸でありDNAと呼ばれるものです。
ひもの形をした設計図 — 核酸 —
核酸の1種であるDNAのひもは2本のセットになっており、それらは互いに絡み合った二重のらせん構造をしています。

DNAの二重らせん
このDNAのひもの上に、4種類の要素 (A, G, C, T) が数珠状に繋がった、配列としてヒトはその設計図を記録しています。
ひもが設計図、配列が設計図というとイメージが付かない人もいるかと思います。ですが、身近なところにも配列を設計図としているものがあります。例えばパソコン上の電子データは0と1の配列で出来ています。

バイナリ配列とその写真
私の携帯に入っているこの写真は5.44 MB=5,448,359 B (バイト)、1バイトは8つの0と1からなるので、4千万程の配列からできています。この配列をコンピューターが読み込むことで、写真として組み立てるわけです。
対して、ヒトのDNAの配列は32億程度といわれており、これを読み込むことでヒトはその身体を組み立てています。
DNA配列とそのからだ
ちなみに、DNAの約99.9%は全てのヒトで共通しており、残り0.1%程度がそれぞれのヒトで異なっています。
それだけしか違わないの?と思うかもしれません。
しかし、0.01%でも配列にして300万の違い、それぞれが4種類の要素で構成されているので、4の300万乗、単純計算で約180万桁以上のバリエーションが存在するわけです。1無量大数が68桁なのでかなり膨大なバリエーションです。
人類70億、それぞれ違った姿をしているのも納得ですね。
さらには、この仕組みはヒトだけでなくネコからトカゲ、はたまた細菌、ウイルスに至るまで、地球上の全ての生物に共通しています。自分と他人のDNAは99.9%ほど共通しているわけですが、ヒトとネコのDNAは90%ほど共通しています。
DNA配列の10%の違いが、我々をネコではなくヒトたらしめているわけです。
どうでしょう、DNA、核酸に対して少しは興味が湧いてきたでしょうか?
設計図と病気
DNAという設計図に、髪の毛や皮膚、筋肉、骨、内臓といったあらゆるものが記録されています。しかし、そういった身体のかたちだけでなく、DNAには仕組みも記録されています。
食べ物を消化する仕組み、物事を考え覚える仕組み、体を動かす仕組み、そして、病気を治す仕組みなど様々です。
つまり、生活習慣や環境による影響だけでなく、DNAの違いによって病気のかかりやすさ、治りやすさが決まっているわけです。
また、生まれつきのものだけでなく、DNAが壊れてしまう事で起きる病気もあります。その最たる例が、がんです。
このように、ヒトの設計図であるDNAと病気には大きな関連があります。
これらの事実が、設計図を治す薬があれば、正しい設計図を薬として入れられれば、という研究へと繋がっていきます。
設計図を薬に
これまでの医薬品と、設計図を標的にした薬、設計図を使った薬は何が違うのでしょうか?
それを理解するために、核酸についてもう少し詳しく説明していきます。
DNAとRNA
これまで、核酸とDNAをほとんど区別せずに説明してきました。しかし実は、核酸というのは総称で、DNAはそのうちの1種類でしかありません。
生物はDNA以外に、もう1つRNAと呼ばれる核酸を持っています。DNAが設計図なら、RNAはどういった役割を持っているのでしょうか?簡単に言ってしまうと、DNAが設計図の原本であるのに対し、RNAは設計図の写しといった関係です。
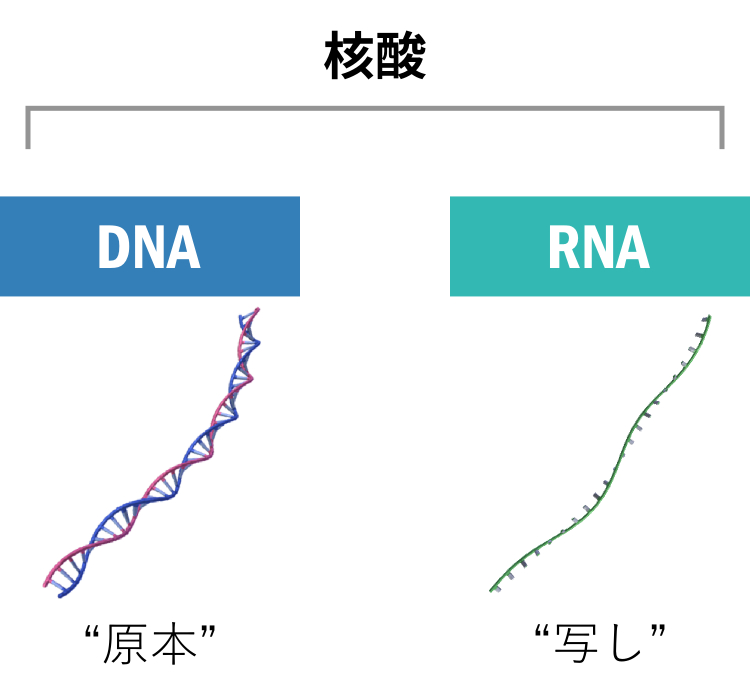
DNAとRNA
DNAを壊してしまうと病気の原因になってしまうなどといった危険があります。そのため、DNAを利用するときには、一度RNAへと写しをとってから身体のパーツ作りをするわけです。
セントラルドグマ
設計図からパーツ作りに至る流れを、もう少し詳しく見ていきましょう。
先ほども述べたように、DNAは設計図、RNAはその写しです。そして、RNAから作られるパーツこそが、いわゆるタンパク質というものです。
DNAからRNAへと配列を写すことを転写、RNAの配列を読んでタンパク質を合成する事を翻訳といいます。そして、この一連の流れを専門用語ではセントラルドグマと呼びます。(かっこいい名前ですね)
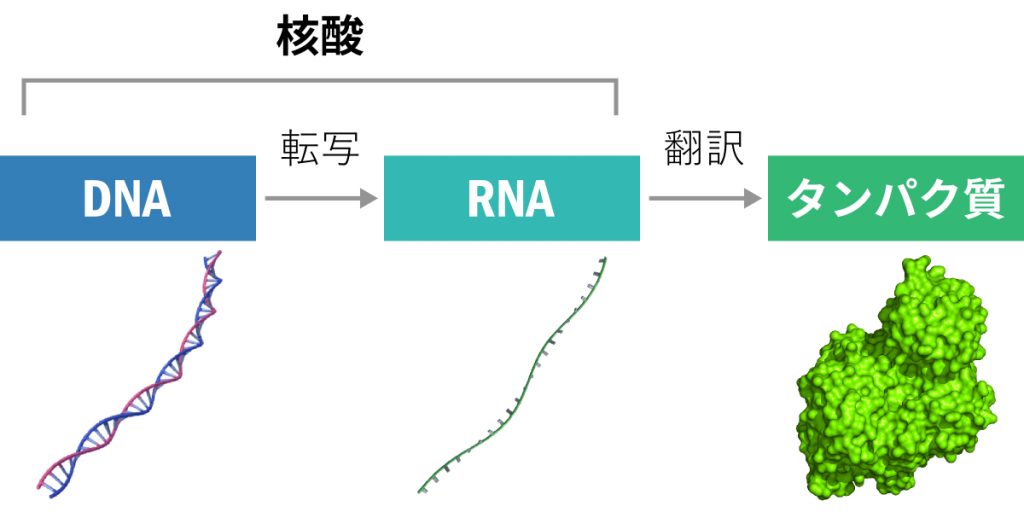
セントラルドグマ (PDB ID: 2D1Q)
これまでの医薬品は、基本的にタンパク質を標的としたものでした。
しかし、身体のパーツであるタンパク質は設計図の核酸と比べ非常に複雑な構造と膨大なバリエーションを有しています。そのため、医薬品の開発にはコストと時間がかかり、その効き目も人それぞれだったりという問題があります。
そこで、より単純な構造である核酸を標的として、医薬品を開発することが検討されました。それでは、どうすれば核酸を標的に出来るのでしょうか?
この為には、核酸の重要な性質を理解してもらう必要があります。
核酸の相補性
初めに、DNAは2本でセットのひも状をしていると説明しました。この2本のセットは何でもいいのではなく、ある決まったDNA同士がセットで結合する事が出来ます。
DNAは4種類の要素 (A, G, C, T) が並んだ配列ですが、この4種類の要素こそがセットを決める法則の鍵になります。
とはいえ、この法則は単純で、AにはTがくっつき、GにはCがくっつくというものです。
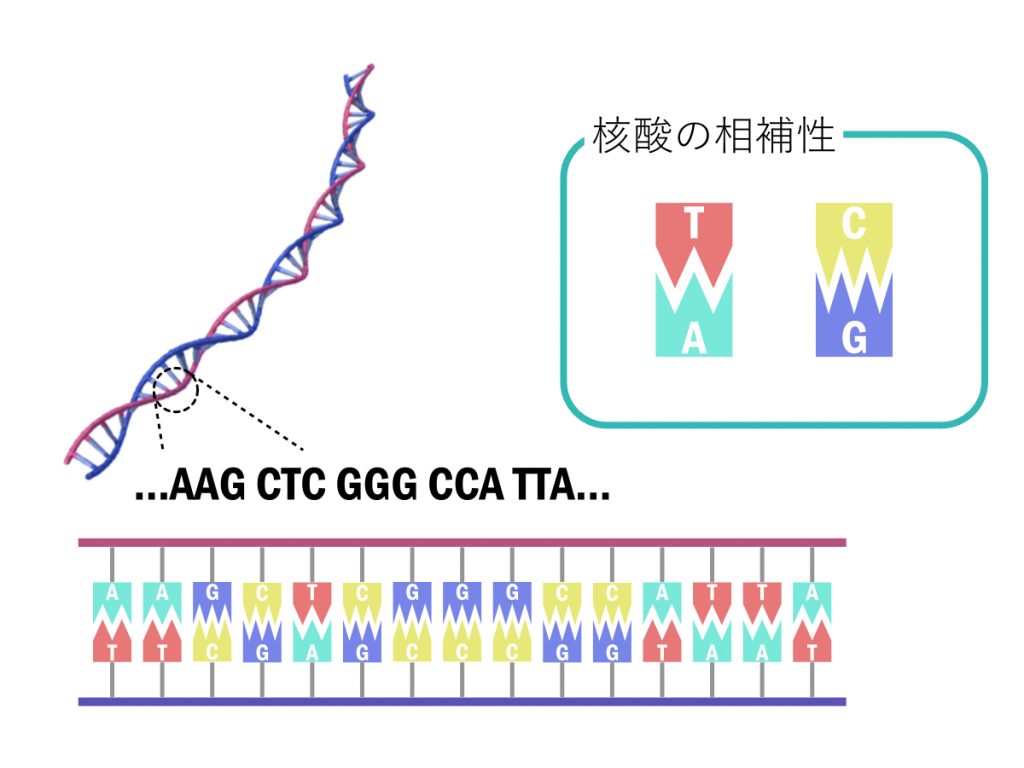
核酸の相補性
例えば、AAGCという配列があれば、TTCGという配列がセットとしてくっつきます。
このように、DNAの2本のセットは対応する配列同士がくっついているわけです。
RNAを標的に — アンチセンス効果 —
決まった配列同士が結合するという法則は、同じ核酸であるRNAにも共通しています。しかし、DNAとは違いRNAは配列を読んでタンパク質を合成しやすいように、2本セットではなく1本だけの状態で存在しています。
実際、DNAから直接タンパク質が合成されることはありません。
では、1本のRNAに対して、セットとなる配列を用意して2本に結合させるとどうなるでしょうか?
1984年、ニュージャージー医科歯科大学の井上正順教授、名古屋大学の水野猛教授らは、「RNAに対し、そのセットとなる配列の核酸によって、RNAからのタンパク質合成を抑制する」という研究結果を報告しました。
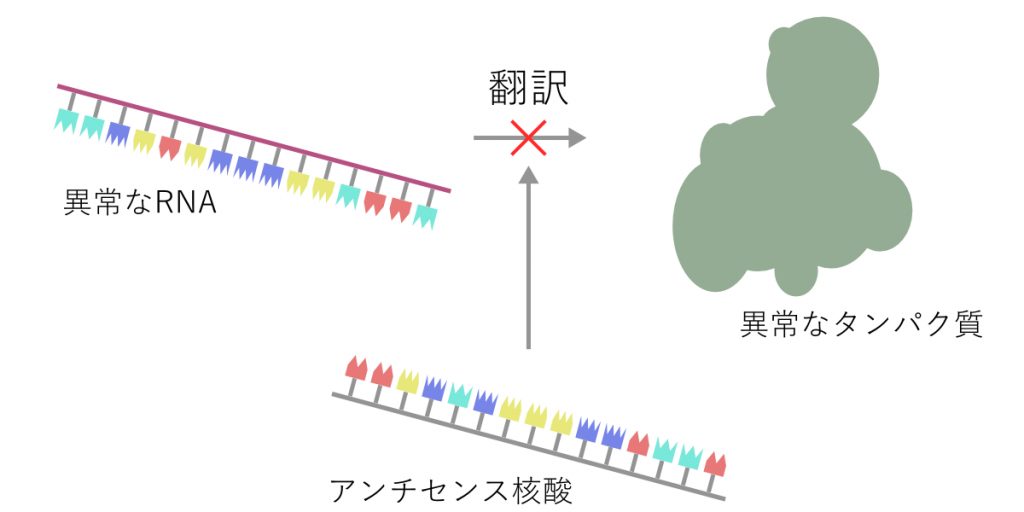
アンチセンス核酸によるタンパク質翻訳の抑制
この現象はアンチセンス効果もしくはアンチセンス法と呼ばれ、その後の核酸研究、並びに生物化学研究の礎となりました。
このアンチセンス効果を用いれば、病気の原因となるタンパク質、ウイルスや細菌のタンパク質を抑えることが可能です。
また、RNAを標的とする事で、それぞれの患者のRNA配列にあわせた医薬品、オーダーメイド医薬品の開発も可能です。
これが現在研究されている、アンチセンス核酸医薬のコンセプトです。
RNA補充療法
もう一つ、核酸を用いた医薬品のコンセプトを紹介します。
こちらはよりシンプルなもので、壊れてしまった設計図、足りない設計図の代わりに正しいRNAを薬として入れてしまおうというものです。
医薬品として補充したRNAから、正しいタンパク質が合成されることで病気を治療する、RNA補充療法という考えです。
アンチセンス核酸、RNA補充療法、これらのコンセプトを基に現在、核酸を用いた医薬品、核酸医薬が研究されています。
核酸医薬の問題点
このように画期的な薬として研究が進められてきた核酸医薬ですが、そこには大きな問題点がありました。
1つは、ただの核酸を皮膚に塗ろうと、口から飲もうと、血管に注射しようと、吸収されないという事でした。生物の体は細胞が集まって出来ていますが、その細胞の中に核酸が吸収されなければ、その効果がありません。
そしてもう1つ、ただの核酸はたとえ体内に入ってもすぐに分解されてしまうという問題がありました。これは、細菌やウイルスの侵入に対する防御システムによるもので、体内に入ってきた核酸をヒトのからだは分解してしまうのです。
私の研究ではこれらの問題点を解決するため、「有機化学」によるアプローチを試みました。
研究内容 / 核酸の構造を弄ってしまおう
有機化学とは、ざっくり言ってしまうと「分子の構造を変化させる」事を研究とした学問です。
核酸も分子の1つというわけで、ただの核酸でダメなら、その構造を細胞の中に入るように、より頑丈な形に、変えてしまおうというのが私の研究です。
課題と戦略
核酸が細胞の中に入れない理由というのは、核酸と細胞膜がいわゆる水と油のような関係にあるからです。核酸が細胞に入ろうとしても、膜にはじかれて通り抜けることが出来ません。
そこで、核酸に対して細胞膜に結合するような構造を付け加えることを考えました。
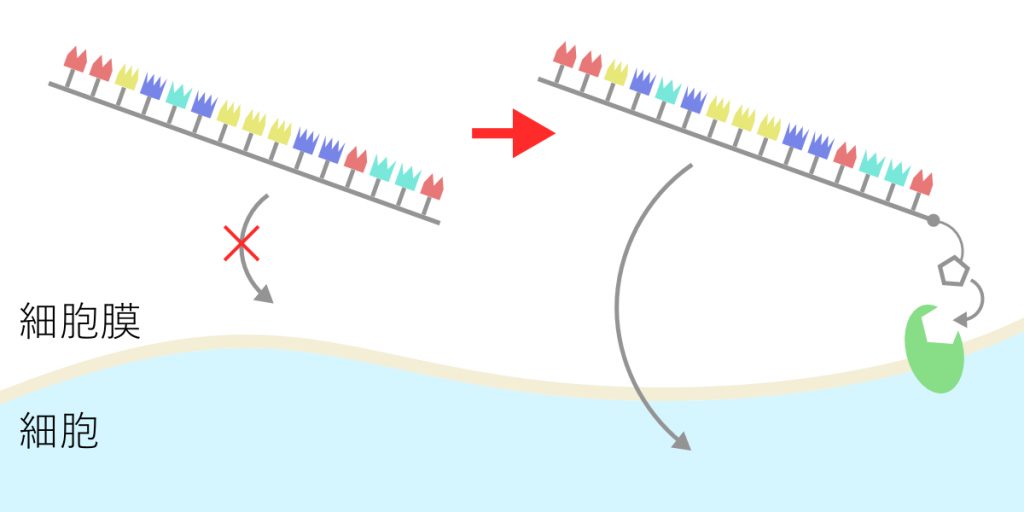
細胞膜を通過する核酸の設計
また、核酸が分解してしまうという問題には、A, G, C, Tという4つの要素に対して、相補性を維持したまま頑丈な構造へと変化させることを考えました。
核酸の合成
それでは、実際の実験の話に移ります。
核酸は、A, G, C, Tという4つの要素が繋がったひも状の分子なので、人工的に合成する際には一つ一つこれらの分子を連結させる事が必要です。
今回私は、核酸を構成しているA, G, C, Tの分子に加え、細胞膜にくっつく分子を合成しました。続いて、これらの分子を繋げて一つの核酸にするという作業を行いました。ここで、用いるのが核酸自動合成機という装置です。
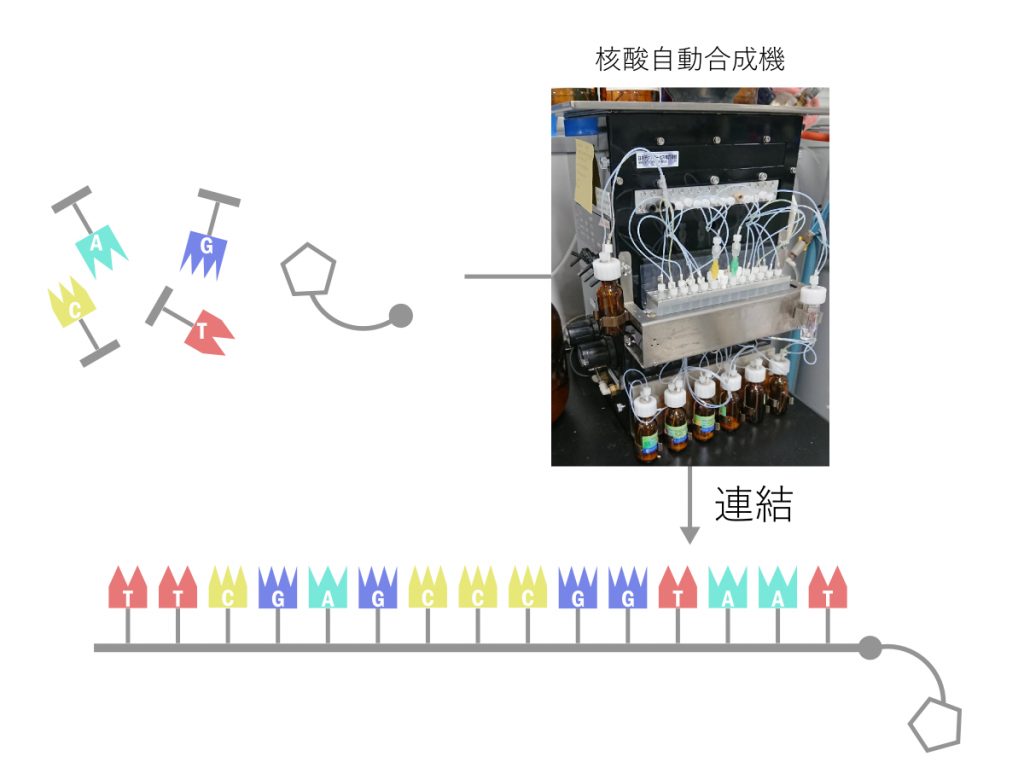
核酸の合成
この核酸自動合成機は読んで字の如く、設定した配列の通りに自動的にA, G, C, Tの分子を繋げて核酸を合成することを可能としています。
この装置を用いることで、様々な配列の核酸を容易に合成することが出来ます。また、今回のように新たな構造を付け加えたり、A, G, C, Tの分子もそれぞれ別の分子へと置き換えることが可能です。
合成核酸の評価
続いて、合成した核酸がどれほどの効果を持つのかを細胞モデルを用いて評価しました。
ここで用いた細胞モデルというのは、ルシフェラーゼと呼ばれるタンパク質をDNAに記録した細胞を用いています。ルシフェラーゼはホタルなどの生物が持つタンパク質で、核酸から合成されると発光するというを特徴を持っています。いわゆるホタルの光る仕組みに関わるタンパク質です。
つまり、核酸の添加によって発光がなくなれば、タンパク質の合成が抑制されていると判断できるわけです。
より良い核酸医薬の開発を目指して
このような実験を通して、私は有機化学による核酸の構造変化と細胞モデルを用いた評価系によって、強い効果を持つ核酸医薬の開発を目指しています。
終わりに / 文献紹介
以上、「ヒトの設計図を使って薬をつくる」と題して、私の研究分野である核酸医薬の開発について紹介させていただききました。
これまでにも、国内外において様々なタイプの核酸医薬の開発が行われています。既に、いくつかの核酸医薬が承認されており、つい先日には今回紹介したアンチセンス核酸医薬の発展形となるsiRNA医薬が承認されたというニュースもありました。
このように、核酸医薬の研究は日進月歩で進行しており、これからの医療に大きな影響を与える可能性を秘めています。
今回の紹介では、ざっくりとさわりのみを書かせていただきました。なので、これだけでは分かりにくかったり、逆に物足りないと感じる方がいらっしゃると思います。
その場合は、気兼ねなく私 (mail: fushidai.covellite@gmail.com) まで質問して頂ければと思います。また、自分でも勉強してみたいという方用に、次の項でいくつか文献を紹介させていただきます。
それでは、ここまでお付き合いありがとうございました。皆さんが核酸、そして核酸医薬というものに興味を持つ一助になれば幸いです。
文献紹介
本記事では、生物や化学に馴染みのない方でも理解できるよう、概念的な説明にとどめました。とはいえ、核酸化学をより深く理解するためには、やはり高校生物、化学レベルの知識が必要になります。
その上で、入門書としてお勧めしたいのが、ブルーバックスの『細胞の中の分子生物学 最新・生命科学入門』です。核酸化学を学ぶ上でベースとなる、分子生物学の基礎がまとめられた一冊になります。
もっと図が多い方がいいという方には、『ビジュアルで見る 遺伝子・DNAのすべて:身近なトピックで学ぶ基礎構造から最先端研究まで』をおすすめします。より発展的な内容にはなりますが、とても綺麗な図や写真が多く読み物としても優秀かと思います。
より専門的な内容としては『ノーベル賞の生命科学入門 RNAが拓く新世界』に詳しく収められています。タイトル通り、RNAに絞った内容ですが、RNA研究の歴史やそれに関わった研究者、背景、意義がまとめられており、核酸について深く知る助けになります。
以上の書籍は、核酸化学におけるベースとなる知識を得る上で有用です。それぞれ専門用語も多く、難解な部分もありますが、根気よく読み進めていただければと思います。
最後に、核酸化学、核酸を用いた創薬研究の最新を知りたいという方には、『核酸化学のニュートレンド』、『核酸医薬の最前線』の2冊をおすすめします。それぞれ、核酸化学におけるより実践的な知識、戦略、これらを基にした最新研究がまとめられています。
[amazonjs asin=”4062579448″ locale=”JP” title=”細胞の中の分子生物学 最新・生命科学入門 (ブルーバックス)”] [amazonjs asin=”4562055782″ locale=”JP” title=”ビジュアルで見る 遺伝子・DNAのすべて:身近なトピックで学ぶ基礎構造から最先端研究まで”] [amazonjs asin=”4061538713″ locale=”JP” title=”ノーベル賞の生命科学入門 RNAが拓く新世界 (KS生命科学専門書)”] [amazonjs asin=”4759813667″ locale=”JP” title=”核酸化学のニュートレンド (CSJ Current Review)”] [amazonjs asin=”4781309011″ locale=”JP” title=”核酸医薬の最前線 (CMCテクニカルライブラリー 517 ファインケミカルシリーズ)”]参考文献
The 1000 Genomes Project Consortium, A global reference for human genetic variation. Nature 2015, 526 (7571), 68-74.
Pontius, J. U., et al., Initial sequence and comparative analysis of the cat genome. Genome Res. 2007, 17, 1675-1689.
Chatterjee, N. and Walker, G. C., Mechanisms of DNA Damage, Repair, and Mutagenesis. Environ. Mol. Mutagen. 2017, 58 (5), 235-263.
Nakatsu, T., et al., Structural basis for the spectral difference in luciferase bioluminescence. Nature 2006, 440, 372–376.
Mizuno, T., et al., A unique mechanism regulating gene expression: Translational inhibition by a complementary RNA transcript (micRNA). Proc. Natl. Acad. Sci. USA. 1984, 81, 1966-1970.
Opalinska, J. B.; Gewritz, A. M. Nucleic-acid therapeutics: basic principles and recent applications. Nat. Rev. Drug Discovery 2002, 1, 503-514.
Gallo, M.; Montserrat, J. M.; Iribarren, A. M. Design and applications of modified oligonucleotides. Braz. J. Med. Biol. Res. 2003, 36 (2), 143-151.
Alam, J. and Cook, J. L. Reporter Genes: Application to the Study of Mammalian Gene Transcription. Anal. Biochem. 1990, 188 (2), 245-254.