初めまして。私は現在、東京大学大学院 医学系研究科の医学博士課程に所属しています。私の研究室ではあるタンパク質に着目し、様々な疾患の原因や治療法の研究を行っています。
医学というとお医者さんが真っ先に思い浮かぶかもしれませんが、研究では医学はもちろん化学や生物、物理など様々な分野の研究者が協力して、1人でも多くの患者さんを救えるよう、日々実験が進められています。
さてここで突然ですが、皆さんはこれまでに病気にかかった事がありますか?
もちろん風邪などは皆経験するものですが、例えば癌などの重い病気には個人差があります。では、この差はいったいどこから来るのでしょうか?
つまり、「なぜA君は○○病にかかったのに、B君はならなかったのか?」ということですね。
私たちの体は、病気の原因と戦い、なるべく正常な状態を保てるようなシステムを持っています。この機能に異常があると病気になってしまうわけですが、どうやらそこに先ほどの疑問に答えるヒントがありそうです。
この記事では、いくつかの疾患をとりあげて、それらに共通するサイエンスに着目してみたいと思います。
はじめに
生体内の細胞リサイクル
最近の研究では、私たちの体は約37兆個の細胞から構成されていることがわかっています。ヒトの細胞は平均して0.02ミリほどですが、この細胞37兆個を全て一列に並べると、どれくらいの長さになると思いますか?
答えはなんと、地球10周分ほどです。
想像も出来ないほどのスケールですが、これらの細胞が私たちの体の基本となり、日々はたらいてくれています。
細胞は分裂し、分化し、様々な役割を与えられます。しかし細胞にも寿命があるため、いずれは死細胞として役目を終えることになります。
これだけの数の細胞が体内にはあるのですから、当然死細胞もたくさんできるはずです。では、私たちの体は一体どのように維持・メンテナンスされているのでしょうか?
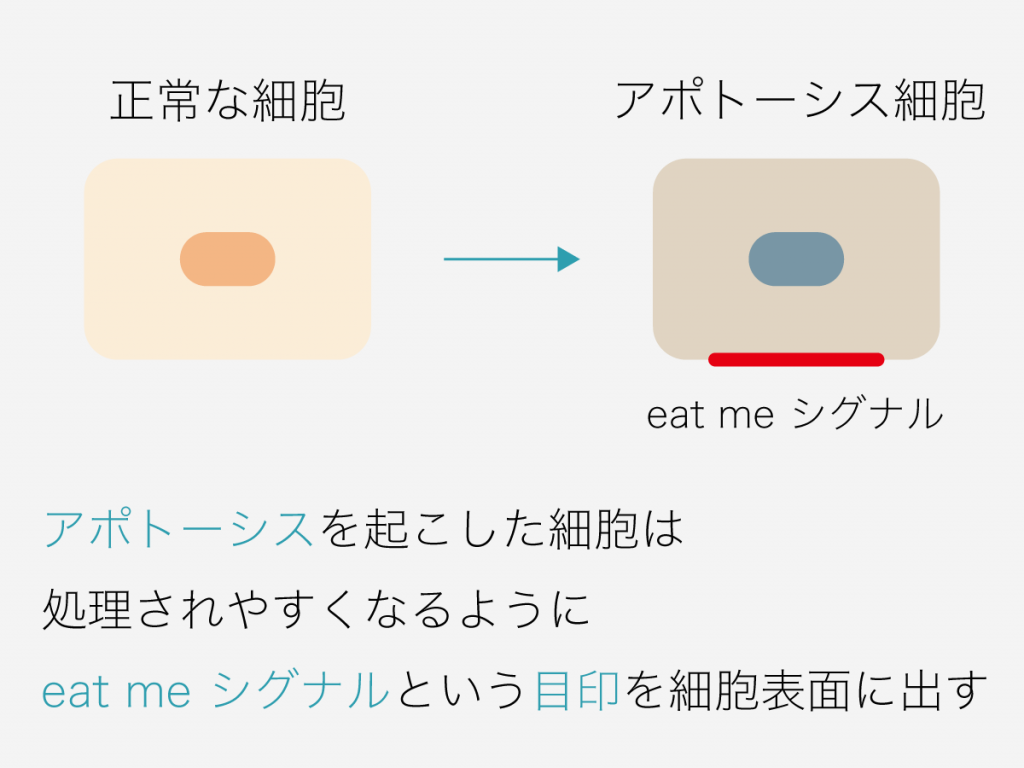
生体を維持するシステムの一つとして、細胞にはアポトーシスと呼ばれる機能が備わっています。
生体内で不要になった細胞は自ら死滅するためアポトーシスを起こし、マクロファージなどの貪食細胞に処理されることで、体内から除かれます。これは一定のプロセスによって進行するため、「プログラム細胞死」とも呼ばれます。
また、このアポトーシス細胞は、細胞表面に「eat meシグナル」というものを出し、マクロファージに見つけてもらいやすくする特徴があります。
正常な細胞まで食べられてしまっては困るので、きちんと目印があるのです。
また、2016年にノーベル生理学・医学賞を東京工業大学の大隅良典教授が受賞されたのは記憶に新しいですが、その受賞理由は体内の細胞やタンパク質をリサイクルする「オートファジー」と呼ばれる仕組みを発見したことでした。
「疾患」の目印はあるのか?
私たちの生体内では、先ほど説明した死細胞の他にも、癌化した細胞や変性したタンパク質など、色々な異常が日常的に発生しています。
これらの「ゴミ」はマクロファージを含む白血球などによって速やかに除去されることで、異常のある組織は修復され、生体内の恒常性が維持されています。
また、このゴミを取り除くシステムが上手くはたらかないと、異物は蓄積したままになり、炎症や組織の繊維化が進み、結果的に「異常」は「疾患」へと悪化してしまいます。
これは皆さんの家と同じです。掃除機でホコリなどのゴミを取り除かなければ、部屋は汚くなる一方ですよね。
部屋に落ちているホコリなどは見れば分かりますから、掃除するのは簡単です。ですが、「生体内のゴミ」がどのように見つけられ、そこから除去されているのかはほとんど分かっていませんでした。
「ここにゴミがあるよ!」とアピールしてくれればいいのですが、どうやらそう上手くはいかないようです。
先ほど例に挙げたアポトーシスについてはこれまで盛んに研究されてきたため、「eat meシグナル」などの目印が明らかになってきています。
ですが、疾患の原因は死細胞だけではありません。
例えば癌であれば異常な増殖をする癌細胞が、アルツハイマー病であればアミロイドβというタンパク質の凝集と蓄積が原因と考えられています。
では、これらの原因に目印はないのでしょうか?
正常な状態ではないのですから、きっと異常を示す何かがあるはずです。
ここからはいくつかの疾患を例に挙げ、これまでに分かってきたことを分かりやすくお伝えできればと思います。
研究背景
様々な機能を持つタンパク質
生命の基本、セントラルドグマ
具体的な話に移る前に、まず基本的な知識をおさらいしてみたいと思います。
私たちの体を構成するのは細胞ですが、細胞内外で色々なはたらきをしているのは主にタンパク質です。
では、このタンパク質はどのようにつくられるのでしょうか?
プラモデルにも組み立て用の説明書が付いている様に、私たちの体にも設計図が存在します。
それがDNAと呼ばれるもので、A(アデニン)、T(チミン)、G(グアニン)、C(シトシン)の4種類の塩基からつくられます。
DNAが二重らせん構造をしている、というのは皆さんご存知かと思います。この構造では、AはTと、GはCと結合するので、4つの塩基の結合相手はしっかりと決まっています。
このDNAからまずRNAが読み取られます。
A→U、T→A、G→C、C→Gと、こちらも相手が決まっています(Aを読み取る場合だけ相手がUになるのが面白いポイントです)。
この過程を転写と呼びます。
このようにしてDNAの情報はRNAとして受け渡されますが、RNAは3文字の並びが1セットとなり、1種類のタンパク質を指定します。
例えばGCGという並びはアラニンというタンパク質を、GAAという並びはグルタミン酸というタンパク質を指定します。
このRNAの並びからタンパク質が決められ、実際にタンパク質がつくられる過程を翻訳と呼びます。
タンパク質は翻訳された後、複雑に組み立てられ、複合体をつくり、その組み合わせによって様々な機能を発揮します。
この、DNA→RNA→タンパク質という機能発現までの流れを、生物学の基本原則という意味で「セントラルドグマ」と呼びます。
セントラルドグマはDNAの二重らせん構造を見つけたフランシス・クリックによって1958年に提唱され、現在では生物によってはこの流れの例外や別の段階が存在することも明らかになってきています。
細胞を長生きさせるタンパク質
さて、ここからは私が研究しているタンパク質についてご紹介していきます。
近年の研究で様々な疾患の目印としてはたらくことが分かってきており、この記事ではマーカータンパク質という意味で「Mタンパク」と呼ぶことにします。
このMタンパクは1999年に発見されたもので、マクロファージが産生します。つくられたあとは血中に出るので、皆さんの血液にもこのMタンパクが存在しています。
また、血中ではIgM(免疫グロブリンM)五量体と結合しています。
発見された当初は、「マクロファージ自身のアポトーシスを防ぎ、細胞を長生きさせる」という特徴が分かっていました。ですが、この特徴と「疾患の目印になる」事とは一見関係がなさそうですよね。
では、一体どのようにしてこのタンパクは目印としてのはたらきをするのでしょうか。順を追って説明していきたいと思います。
癌細胞の目印
脂肪との関連性が明らかに
繰り返しになりますが、様々な病気において、死細胞や変性した異常なタンパク質が原因になることは分かっていました。しかし、それがどのように除去されるのか、その目印が何なのかはほとんど分かっていませんでした。
先ほど説明したMタンパクですが、マクロファージから血中に分泌されると、血流に乗って体の様々な組織に行き渡ります。その中でも脂肪組織では脂肪細胞がMタンパクを取り込むことが発見されました。
そして取り込まれたMタンパクは細胞内で直接はたらき、その結果細胞内の中性脂肪が分解されるということが分かりました。この仕組みは肝臓でも見られ、肝細胞内の脂肪を溶かし、脂肪肝を防ぐ効果も見つかりました。
生活習慣病の一つであるメタボリックシンドロームも、普段はこのMタンパクのはたらきで抑制されている、ということです。
癌化した細胞の目印に!
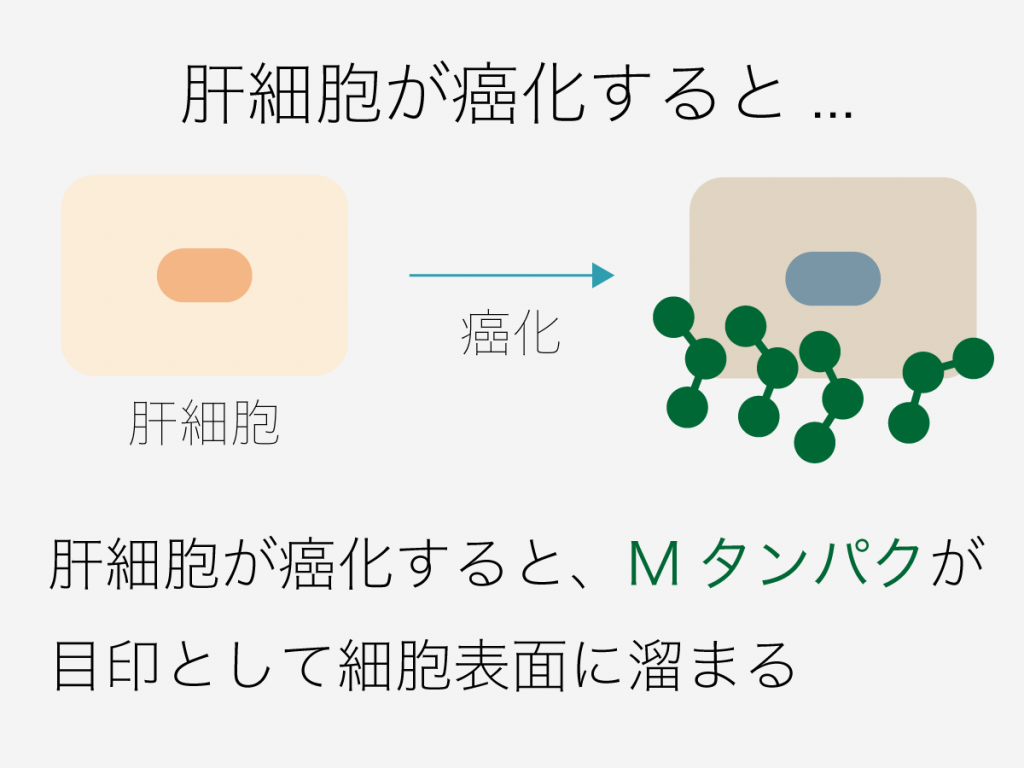
このように、Mタンパクは「マクロファージのアポトーシスを防ぐ」だけでなく「細胞内での中性脂肪の蓄積を防ぐ」はたらきをします。
そしてここからが面白いポイントなのですが、肝細胞が癌化するとMタンパクは細胞内に取り込まれるのではなく、細胞表面に溜まることが分かりました。
そしてこのMタンパクが目印となって、免疫機能の一つである補体が活性化し、癌化した肝細胞を攻撃するようになるのです。
つまり、Mタンパクは通常は細胞に取り込まれて脂肪を分解していますが、肝細胞が癌化すると「ここに癌細胞があるぞ!」と目印になるはたらきを持っていたのです。
目印としての機能はありそうだが…?
このように、Mタンパクが「生体内のごみ」の目印になる可能性が示されました。ですが、肝癌細胞の目印にはなりますが、他の疾患との関わりはまだ分かっていませんでした。
そのような中で、私が着目したのが急性腎障害という腎臓の疾患です。
腎臓内の尿細管に死細胞が蓄積してしまうことで発症し、腎臓の機能が著しく低下してしまう疾患です。
Mタンパクが「癌化した肝細胞」の目印になることが分かったので、私は「死細胞」の目印になるかどうかを確かめてみよう、というわけです。
筆者の研究~急性腎障害との関連性に迫る~
Mタンパクは本当に腎障害と関連があるか?
急性腎障害とは
急性腎障害は腎臓内の血流障害、敗血症、尿毒素など、様々な原因によって誘発される疾患です。腎機能が急激に低下してしまい、炎症なども伴います。
病態が悪化すると腎不全などより深刻な状態に進行してしまいますが、根本的な治療法は未だ見つかっていません。
急性腎障害の際には腎臓内の尿細管上皮細胞がはがれ落ち、死細胞として蓄積することが特徴です。曲がりくねったホースにゴミがたくさん詰まっている状態をイメージすると分かりやすいかもしれません。
この死細胞が効率良く除去されれば良いのですが、蓄積したままだと疾患の原因になってしまいます。
ノックアウトマウス
今回は急性腎障害に着目してみたわけですが、まずはMタンパクが本当にこの疾患と関わりがあるかどうかを調べてみる必要があります。
「ある遺伝子がどのようなはたらきをしているか知りたい」と思った時に、生物学の分野ではよく「ノックアウトマウス」を用いて検証します。
マウスは実験用のネズミのことですが、ノックアウトという単語は聞き慣れないかもしれません。これは遺伝子操作技術によって、目的の遺伝子を欠損(=無効化)することを指します。
つまり、目的の遺伝子がないことでマウスにどのような影響が出るかをチェックする、ということです。
野生型マウスとの比較
生物学に限らず、数値や程度を示す実験をする際には「比較」がとても大切です。
ただ「Aに○○したらこのような結果が出ました」というだけでは説得力がないので、必ず比較対象(コントロールと呼びます)を置く必要があります。
やや大雑把な説明ですが、「僕はテストで70点を取った」と言っても、それだけでは凄いかどうかは分からないですよね。これが「僕は平均点が50点のテストで70点を取った」だと、優秀であることの説得性が出ます。
さて、今回は「野生型(=遺伝子操作などは何もしていない)マウス」と「Mタンパクを指定する遺伝子を欠損させたノックアウトマウス」を比較してみます。
実際はもっと細かくコントロールを設定しているのですが、この記事では分かりやすくするため、この2グループの比較で説明をします。
両グループへ腎障害を誘導
まず、野生型マウスとノックアウトマウスの両グループに手術をし、急性腎障害を人工的に起こさせます。
すると野生型マウスは時間とともに回復したのに対し、ノックアウトマウスは死亡率がとても高く、生存したマウスも腎機能が極度に低下している様子が観察されました。
この実験結果より、Mタンパクはどうやら急性腎障害と関係がありそうだ、ということが分かりました。
腎臓の状態を観察
次に、両グループのマウスの腎臓を摘出し、詳しく観察してみました。
観察するのは主に尿細管です。
野生型のマウスでは、死細胞は時間の経過とともに除去されていきました。
それに対し、ノックアウトマウスにおいては死細胞の減少はほとんど見られず、尿細管に残ったままでした。また炎症も長く続いており、その結果腎機能が低下すると考えられました。
死細胞の除去メカニズムについて
KIM-1タンパクに着目
これで「Mタンパクが急性腎障害と関わりがあること」「Mタンパクがないと死細胞が除去されないこと」が分かりました。
では、なぜMタンパクがないことで死細胞は除去されず、尿細管に残ったままになるのでしょうか?
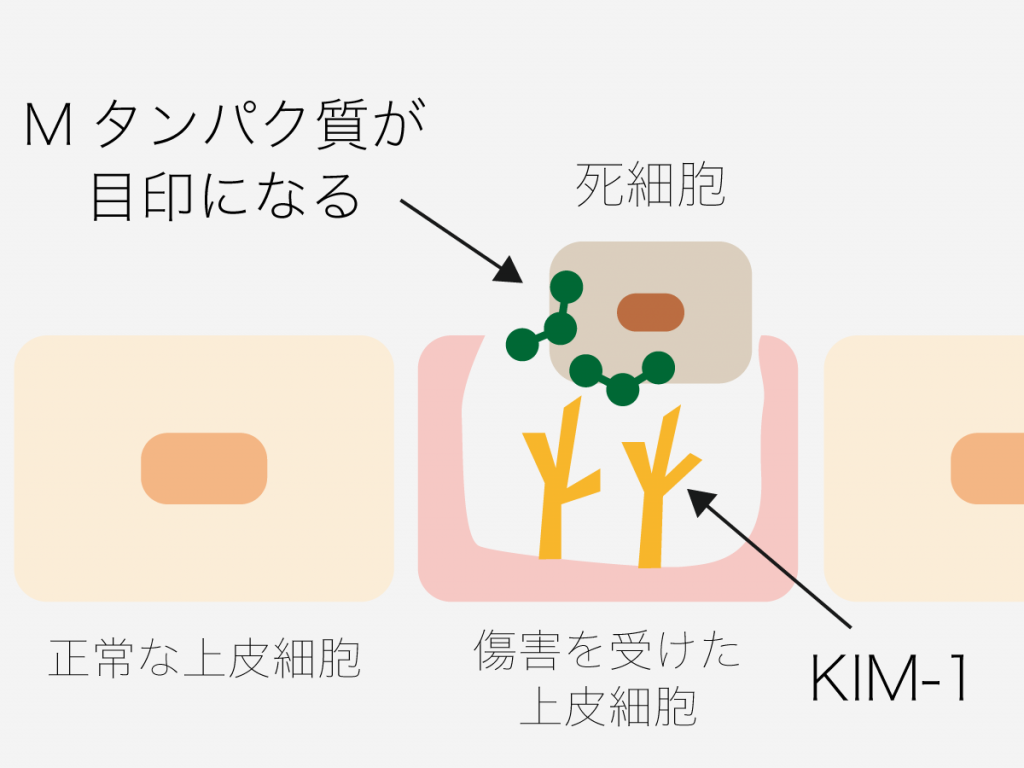
私たちはこの謎を解くために、腎臓がダメージを受けた際に発現される「KIM-1」というタンパク質に着目しました。
KIM-1は尿細管上皮細胞が主に発現し、上皮細胞自身を貪食細胞へと変化させ、死細胞の除去に関わることが知られています。
ですが、どうやって死細胞を認識しているのかまでは分かっていませんでした。私たちはここにMタンパクが関わっているのではないかと考えたのです。
なぜMタンパクがないと死細胞は除去されないのか?
今回急性腎障害を誘導した野生型マウス、ノックアウトマウスの両グループでもKIM-1の発現上昇が確認されました。
ここで尿細管を再度詳しく観察してみると、尿細管の中に溜まった死細胞にMタンパクが付着している様子が確認されました。
そこで、「KIM-1によって上皮細胞が死細胞を除去するためには、Mタンパクの付着が必要なのではないか?」と仮説を立てました。
このような仮説を検証する際、マウス実験から一度離れ、培養細胞での実験を行うことがよくあります。今回は上皮細胞とKIM-1タンパク、Mタンパクの3種類を用いて実験を行いました。
KIM-1を人工的に発現させた上皮細胞とMタンパクを観察したところ、MタンパクがKIM-1と結合し、細胞内に取り込まれている様子が確認されました。
この結果より、「腎臓の尿細管では、死細胞に付着したMタンパクがKIM-1によって認識されることで除去が進む」という仮説は正しそうだ、と考えられます。
MタンパクとKIM-1の相互作用
次に野生型マウスの腎臓で、MタンパクとKIM-1がどこにあるのかを調べました。すると、KIM-1を発現している尿細管上皮細胞が、Mタンパクの付着した死細胞を取り囲む様子が観察されました。
また、一部の死細胞は上皮細胞に取り込まれているようでした。
この現象を培養細胞で確かめてみます。
まずシャーレ上でKIM-1を発現させた尿細管上皮細胞を培養します。ここに、①Mタンパクを付着させた死細胞と②何も付着させない死細胞の2種類を添加します。すると、Mタンパクが付着した死細胞の方が、より効率的に上皮細胞に貪食されることが分かりました。
そして実際にノックアウトマウスにMタンパクを投与した結果、死細胞にMタンパクが付着し、その後除去される様子が確認されました。また、死亡率も改善されていました。
MタンパクとIgM
最後に、Mタンパクのメカニズムについて少し説明します。
Mタンパクが血中ではIgM五量体と結合していることは最初の方で軽く触れました。
実はこのままではMタンパクは機能を発揮できない状態にあります。Mタンパクが腎臓内の死細胞に付着するためには、このIgMから離れて自由な状態になる必要があるのです。
実際にマウスの血液や尿を調べたところ、通常時ではMタンパクはほとんど検出されなかったのに対し、急性腎障害を誘導したマウスでは「自由型」が顕著に増加していることが分かりました。
ここから新しい仮説が立てられます。
つまり、「通常時はIgMと結合しているMタンパクが、急性腎障害の際には離れて腎臓内の死細胞に付着する」のではないか、ということです。
しかし、MタンパクがIgMから離れるメカニズムや、そのために必要な条件などはまだ詳しくは分かっていません。
この解明のためには、今後より研究を進めていく必要があります。
この研究のまとめ
今回明らかになった事を、以下に簡単にまとめました。
- Mタンパクが死細胞の「目印」となって、急性腎障害という病気の治癒に関わっている
- 急性腎障害が起こるとMタンパクが尿中に移行し、死細胞に付着することで、除去が促進される
- Mタンパクの投与によって、これまで治療法がなかった急性腎障害の治療が可能になるかもしれない
おわりに
正常と異常
この記事では主に「脂肪・肝がん」と「腎障害」の2つの疾患をご紹介しましたが、Mタンパクに関する研究は現在進行形であり、その他の疾患との関連性を調べるべく、私たちは日々研究に励んでいます。
この記事の最初の質問ですが、「なぜ病気になる人とならない人がいるのか?」でした。
もちろん明確な答えは現段階では出せませんが、もしかすると、生まれつきMタンパクの血中濃度が高い人は「体内の異常検知能力」が高いのかもしれません。
Mタンパク以外にも疾患の目印が存在する可能性は十分にありますし、このような機能がいくつも合わさって私たちは健康を維持できているのだと思います。
ネコとの関わり
最後に面白いトピックを1つ。
Mタンパクはヒトだけでなく、他の動物にも存在します。皆さんの中でネコを飼っている方もいらっしゃると思いますが、実はネコの死因の上位に腎不全があります。
Mタンパクは血中でIgMと結合していることは前の章で説明しましたが、実はネコはこの結合力がヒトよりもずっと強いのです。
つまりなかなかMタンパクが自由になれず、その機能を発揮できない状態なのです。
そのため腎障害が起こってもMタンパクはIgMに結合したままなので、結果的に死細胞は除去されにくく、ネコは腎不全になりやすいと考えられています。
逆に言えば直接Mタンパクを薬として投与すればネコの腎不全を治療できるかもしれない、ということです。実際に研究室ではネコの治療薬を開発するプロジェクトも進められています。
筆者から皆さんへ
このようにヒトだけでなく、他の動物でも共通して様々な疾患に関わりのあるMタンパク。遺伝子やタンパクから実験用マウス、そしてヒトや他の動物までを自分のアイデアで繋ぐことができるのが医学研究の面白さです。
医学研究に分野の壁はありません。実際私も学部では化学を学んでいましたが、大学院から医学の道に進みました。
もし少しでもこのような研究に興味を持ち、また将来この分野を目指してくれる方が1人でも増えてくれたらこれ以上の喜びはありません。
少し長くなりましたが、最後までお読み下さりありがとうございました。