こんにちは.
大阪大学大学院 工学研究科 量子ビーム応用工学領域 博士前期課程1年の下条裕と申します.
私のラボでは,医工連携によって最先端の光・レーザー技術を臨床へ橋渡しをするための研究(Translational Research)に取り組んでいます.
レーザーと聞いて何が思い浮かびますか?
CD,DVDのAV機器,光通信,レーザー脱毛,講義で使うレーザーポインター,
音楽ライブの照明……
レーザーは医療に限らず,情報通信や工業などの幅広い分野に応用されています.
しかしながら,レーザーとは何か?と聞かれると正確に答えるのはなかなか難しいのではないでしょうか.
そこで,私の研究の説明の前に,レーザーの特徴を説明したいと思います.

レーザーの性質を理解する
Laser とは?
Light Amplification by Stimulated Emission of Radiation
(誘導放出による光の増幅)
の頭文字を取った言葉です.
レーザー光の大きな特徴は,時間的・空間的コヒーレンス(=可干渉性:干渉縞が明瞭に識別できる)です.干渉縞は干渉により生じる明暗の縞です.
時間的コヒーレンス:異なる時間にレーザーを発した光波の干渉
空間的コヒーレンス:同じ時刻に異なる場所からレーザーを発した光波の干渉
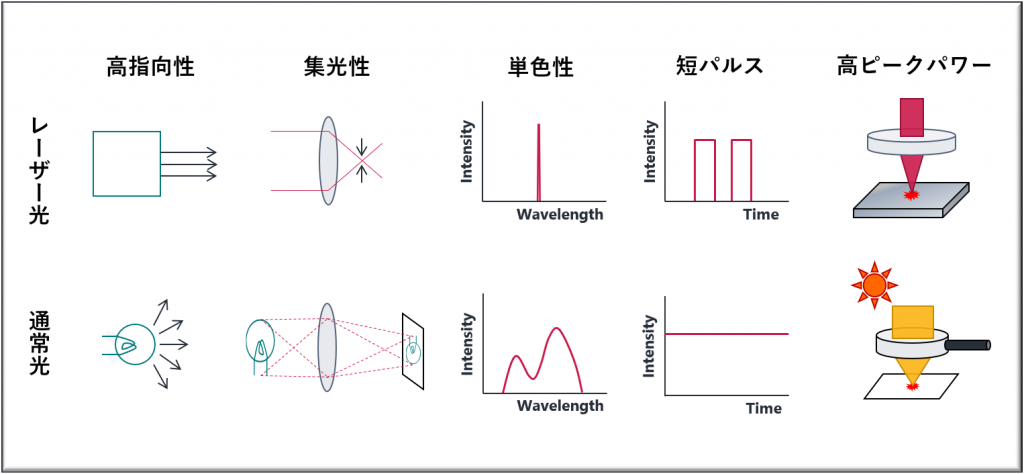
この特徴によって,レーザー光は以下のような性質を持っています.
レーザー光の性質
- 高指向性(空間的コヒーレンス)
長距離を伝播しても広がりません.測量や距離測定(月との距離など)に用いられます. - 集光性(空間的コヒーレンス)
非常に狭い領域に集光が可能です.CD,レーザー加工,レーザーメスなどに用いられます. - 単色性(時間的コヒーレンス)
連続的に様々な波長の光を含む太陽光に対して,レーザー光は単一波長で構成されます. - 短パルス(時間的コヒーレンス)
モード同期により短時間(~フェムト秒: 10-15)のレーザー照射を繰り返して発生させることが可能です. - 高いピークパワー(時間的コヒーレンス)
強い超短パルスを狭い領域に集光することにより高いピークパワーを得ることができます.
レーザーデバイスの医療・医用応用
レーザーデバイスを用いた医療といえば,脱毛やレーシック(LASIK)が有名ですが,実は幅広い診療科に応用されています.

研究背景
生体内の光の挙動を扱う学問―生体組織光学―
生体組織光学とは,生体内における光の伝搬およびそれに伴う物理・化学現象の解析を踏まえて光による生体作用を議論する学問です.
生体組織内の光伝搬
対象となる疾患部位・組織にレーザーを照射すると,一部は組織で反射され,屈折した残りの光は生体内で吸収・散乱によって減衰します.これを生体内の光伝搬といいます.
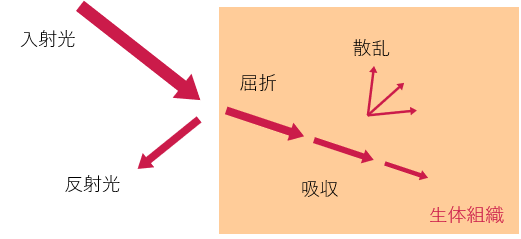
反射光は,生体に影響を及ぼさない光です.散乱によって光が生体内で拡散されます.そして,吸収される光が生体に対する相互作用を引き起こします.
光伝搬に伴う生体相互作用
生体相互作用には,熱的作用や機械的作用といった物理プロセス,活性酸素の発生といった化学プロセスがあります.この作用によって治療効果が生み出されます.
そのため,適切なレーザー照射パラメータを選択することで,光吸収・散乱の違いによって影響部位を選択することや,生体組織内におけるレーザー生体相互作用を決定することが可能になります.
レーザー照射パラメータには主に,波長,パワー密度,パルス幅が含まれます.パワー密度は単位面積・単位時間にかかるエネルギー,パルス幅はパルスが継続する時間を表します.
レーザー照射パラメータに応じた光伝搬およびそれに伴う物理・化学現象の解析を行えば,科学的根拠に基づく定量的なレーザー治療の評価の実現に繋がります.
これによって,必要とされる作用のみを病変組織に与え,余分な熱的・機械的損傷などの副作用を最小限に抑える治療が可能になります.
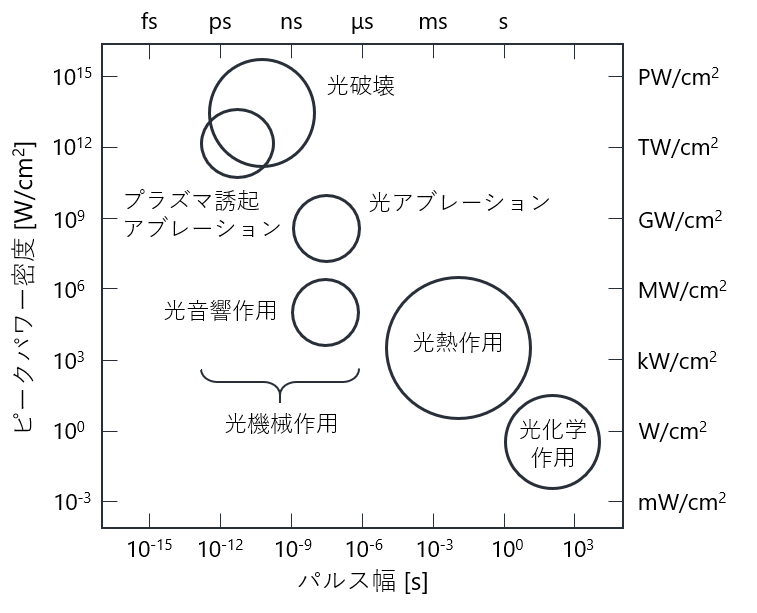
出典: 粟津邦男. 赤外レーザー医工学, 大阪大学出版会 (2008).
レーザーデバイスが臨床応用されるまで
レーザーデバイスをはじめとする医療機器は,開発されたら即座に臨床現場で使用できるものではありません.
前臨床試験(動物実験)や臨床試験(治験)を行い,厚生労働大臣から製造販売承認を取る必要があります.
つまり,その医療機器によって安全で有効な治療ができるということを試験で実証し,国からお墨付きをもらう必要があるのです.
一般的に,医療機器が上市されるまでに,
開発・基礎研究 → 前臨床試験 → 臨床試験 → 申請・審査 → 承認
というフローがあります.

その医療機器によるベネフィットとリスクを天秤にかけて,ベネフィットの方が大きいと審査の段階で判断されれば,承認を取ることができます.
そのためには,既存治療と比較した際の臨床上の有用性や意図した性能(有効性)および合併症や発がん性,不可逆的なリスク(安全性)を確認・確保することが求められます.

レギュラトリーサイエンス
ここまでの説明で,医療機器の実用化には,安全性・有効性の評価が必要であるということがわかったと思います.
では,その安全性・有効性を何をもって評価するのか?という疑問を持ちますよね.
医薬品・医療機器等の評価は,客観的な指標,つまり科学的根拠に基づいて実施することが求められます.
そのような評価の科学をレギュラトリーサイエンスといいます.
医薬品・医療機器等の研究開発の成果の実用化に際し,品質・有効性・安全性を科学的知見に基づき,適正かつ迅速に予測,評価および判断することに関する科学.
独立行政法人医薬品医療機器総合機構ホームページ「レギュラトリーサイエンスについて」
https://www.pmda.go.jp/rs-std-jp/outline/0001.html
レギュラトリーサイエンスに則った議論が,レーザー治療の評価に生体組織光学を応用することで可能になると考えています.
研究内容/新規レーザーデバイスのTranslational Research
ここまで,「生体組織光学」と「レギュラトリーサイエンス」について説明をしてきました.
この背景を踏まえて,私が取り組んでいる新規レーザーデバイスのTranslational Research(光学デバイスを臨床応用するための橋渡し研究)について説明を進めていきます.
新規医療・医用レーザー装置の安全性・有効性を評価するために,生体組織光学に基づいた計算機シミュレーションモデルを開発しています.
現在は,皮膚科・形成外科で刺青除去や色素性病変治療に対して使用される新規ピコ秒パルスレーザーをターゲットにしています.
従来の試験法の課題
1. 生体組織光学的アプローチがとられていない
ピコ秒パルス光を生体組織に照射した際に生じる現象を実験で計測することは難しいです.
そのため,従来の前臨床・臨床試験では,治療のエンドポイントにおける組織の状態を観察することで安全性・有効性の評価を行っていました.
臨床研究の文献を見ていると,皮膚の病変部にレーザー光を照射して,治療効果(色素がどれだけ除去できたか)や熱損傷や痛み等の副作用を専門家が判断し,従来の治療法との統計的な比較によって治療の安全性・有効性を行っていました.
このような評価手法では,生体組織光学的アプローチに基づく解析によって治療の評価を行うことができません.
なぜ治療効果が生じたのか,なぜ副作用が大きいのかという考察を科学的根拠に基づいて行うことが困難になります.
2. 試験に多大な時間・費用が必要
また,試験に多大な時間・費用を要することが新規光学装置の迅速な臨床応用の課題になっています.
どんなに優れた医療機器,治療法が開発されても,経済面からの採算が取れなければ,上市(新製品を販売)することが難しくなります.
3. 試験に係る倫理的問題
さらには,2013年にヨーロッパで化粧品に関する動物実験が禁止されたように,従来の試験が実施できなくなる局面も今後予想されます.
このように,時間・費用・倫理上の制約を根本的に解決できる定量的かつ再現性の高い評価手法が求められます.
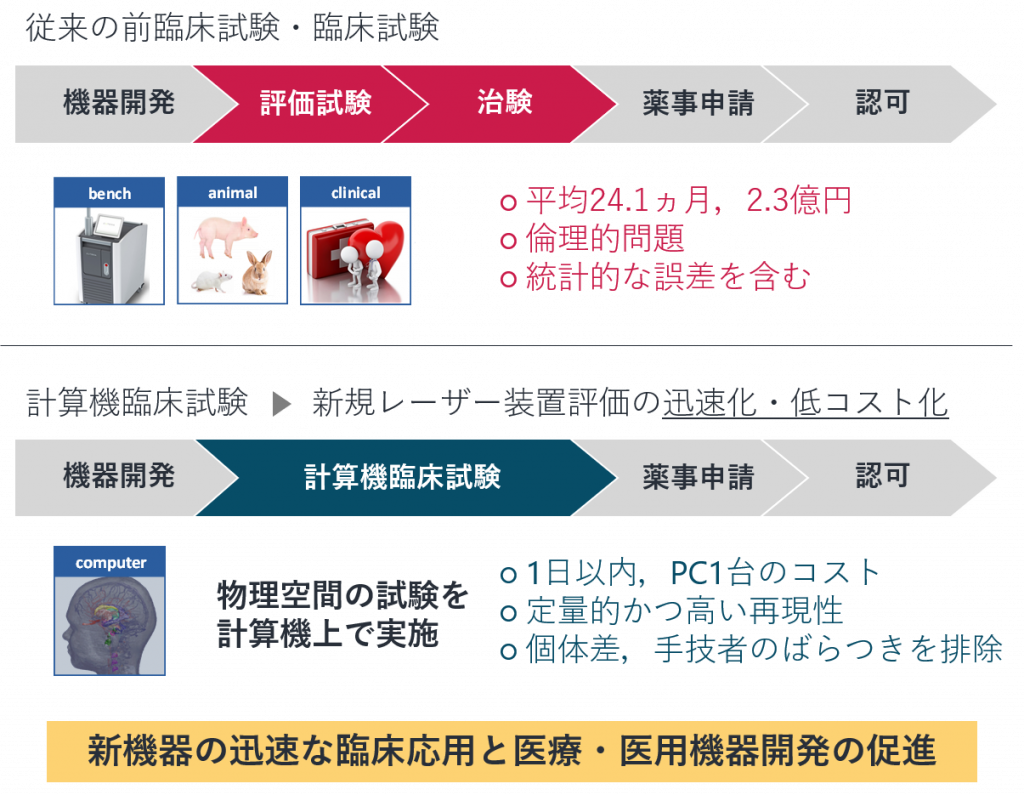
計算機臨床試験法
計算機臨床試験とは?
前臨床・臨床試験は,動物実験のデータから推定されたヒトへの影響や被験者・手技者のばらつきを含む実験データを扱います.
それに対して,前提条件の明確なシミュレーションの下で試験を実施した方が根拠が明確になるのでは?という着眼点を持ちました.
そこで私たちは,一連のレーザー治療プロセスをモデリングとシミュレーションに基づいて計算機上で再現する試験法を提案しています.
これを,「計算機臨床試験法」と言います.
この方法論は創薬分野の薬物動態シミュレーションへすでに応用されており,米国の食品医薬品局(FDA)も安全性・有効性をサポートする科学的根拠の収集方法と判断しています.
in Biophotonics Congress: Optics in the Life Sciences Congress 2019 [一部改変].
計算機臨床試験の実現による恩恵
これまで物理空間で実施されていた前臨床・臨床試験を計算機上で再現してレーザー治療の安全性・有効性を評価できれば,迅速・低コストなレーザーデバイスの臨床応用が可能になると考えています.
これにより,最先端のレーザーデバイスを迅速かつ広範囲に臨床応用するための計算機臨床試験法に関する方法論を確立することを目指しています.
デバイスの開発から臨床試験までの全プロセスを計算機上で実施する手法はこれまでに確立されていません.
そのため,本研究の成功は,医療機器全体における評価試験の方法論を改革することに繋がります.
ピコ秒パルスレーザーによる熱損傷の計算的評価
皮膚科・形成外科において実施されている新規ピコ秒パルスレーザー治療に対して,計算機臨床試験にて安全性評価を試みました.
一例として,日本で未承認のピコ秒レーザー装置を用いた皮膚治療の安全性を熱損傷の観点から評価しました.
評価は,正常皮膚組織へレーザー光を照射した際の温度上昇と熱損傷を安全性の評価指標として,薬事承認取得済みのナノ秒パルスレーザーと比較しました.
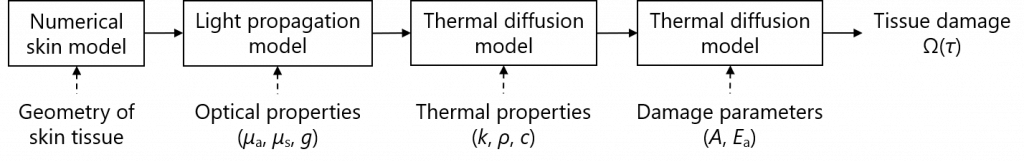
熱損傷モデルに基づいた光治療シミュレータの構築
レーザー治療から生じる熱損傷のシミュレーションモデルを構築しました.
in Biophotonics Congress: Optics in the Life Sciences Congress 2019 [一部改変].
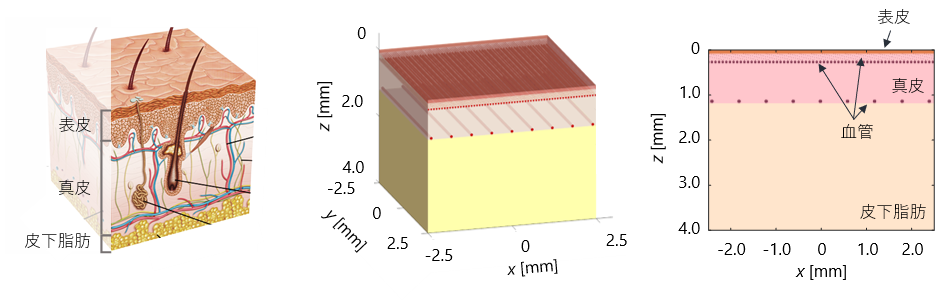
また、レーザー照射中(治療中)の皮膚組織内における光伝搬を計算するためのヒト皮膚組織モデルを構築しました.
ヒト皮膚組織モデルは,表皮,真皮,皮下脂肪,血管から構成されています.
in Biophotonics Congress: Optics in the Life Sciences Congress 2019 [一部改変].
次に,皮膚組織にレーザー光を照射した際の光分布をモンテカルロ法という手法を用いて計算しました.
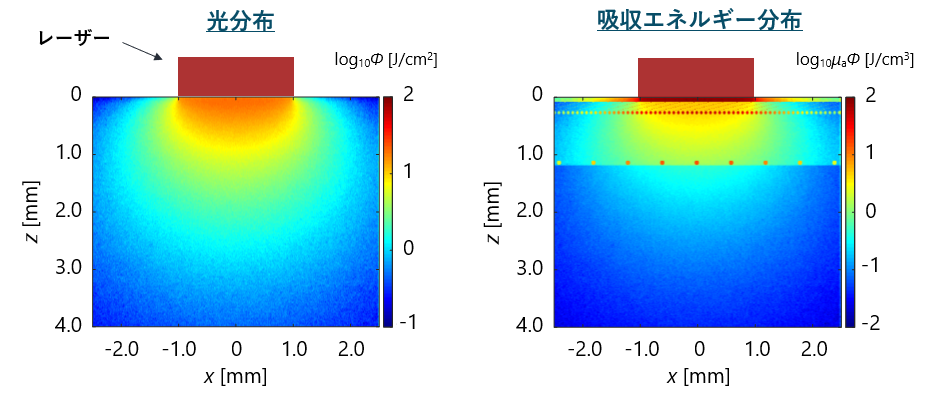
光が照射部から放射状に拡散され,表皮と血管によく吸収されていることがわかります.
その後,レーザー光照射によって吸収したエネルギーを熱源として,皮膚組織内の温度上昇の時間変化を生体熱伝導方程式を用いて計算しました.
光治療シミュレータによる計算機臨床試験の結果
下図の結果より,ピコ秒パルスレーザー照射による皮膚組織の温度上昇は,ナノ秒パルスレーザー照射と比較して同程度あるいは低いということがわかりました.
また,熱損傷は,表皮で最大となり,ナノ秒パルスレーザー装置における38 %に対し,ピコ秒パルスレーザー装置では8.9×10-3 %でした.
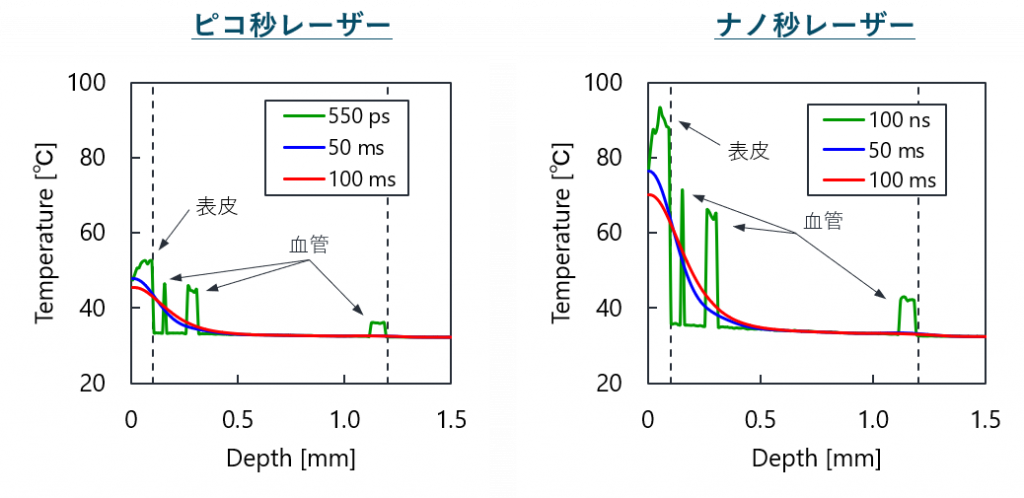
in Biophotonics Congress: Optics in the Life Sciences Congress 2019 [一部改変].
本結果は, 海外での臨床研究における熱損傷に起因する副作用の評価と同等の結果を示していました.
日本で未承認のピコ秒パルスレーザー装置を対象とし,既承認のナノ秒パルスレーザー装置と安全性が同等であることを計算機シミュレーションを用いて実証することができました .
本研究で実施した試験では,従来の試験と比較して数日間,PC1台分の費用にまでの迅速化・低コスト化に成功しました.
今後の展望
レーザー生体相互作用の数理モデルの改良と数理モデルに必要な物理パラメータの実測により,確度の高い光治療シミュレータを実装することが今後の課題です.その課題解決に向けて以下の2つの研究に取り組んでいます.
レーザー生体相互作用の数理モデルの改良
ピコ秒パルスレーザー皮膚治療は,熱的作用だけでなく機械的作用も治療効果に寄与するため,熱損傷が小さく治癒効果も高い,と通説ではいわれています.
しかし実際は,その作用メカニズムは理論的にも実験的にも不明確なままであるのが現状です.
そこで,ピコ秒パルス光と皮膚との相互作用を実験によって解明し,そのメカニズムを含めた数理モデルを構築することで,レーザー生体相互作用の数理モデルを改良します.
モンゴロイド皮膚組織の光学特性値測定
光伝搬を計算する際に光学特性値が必要になります.光学特性値は,生体内における光の振舞い(吸収・散乱)を決定する物理パラメータです.
皮膚組織の光学特性値は人種によって変化するため,高精度な皮膚組織内の光伝搬計算を行うためには,モンゴロイドのデータが必要になります.
これまでに光学特性値の解析は多く報告例がありますが,その多くはコーカソイド・ネグロイドであり,モンゴロイドに関しては不十分であるのが実情です.
現在,臨床医との共同研究によりモンゴロイド皮膚組織の光学特性値の解析を進めています.
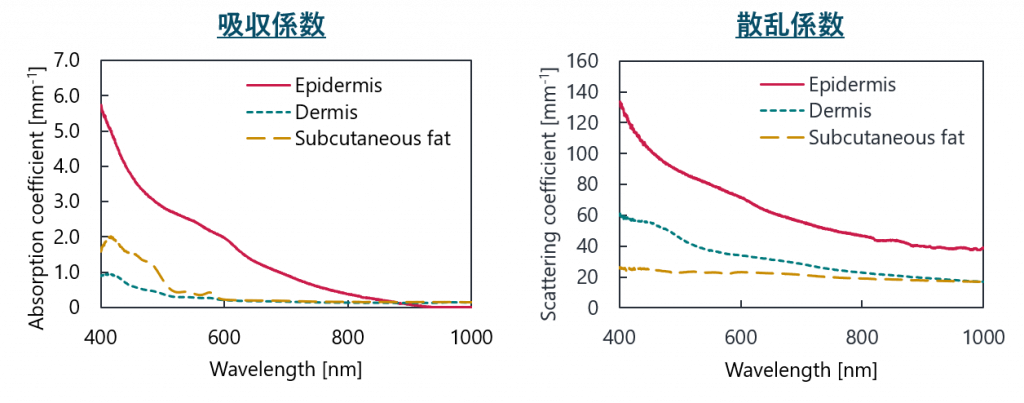
出典: Y. Shimojo et al., “In silico Evaluation of Thermal Skin Damage Caused by Picosecond Laser Irradiation,”
in Biophotonics Congress: Optics in the Life Sciences Congress 2019 [一部改変].
本研究が完成すれば,レーザー生体相互作用の数理モデルが確立されるため,すべてのレーザー治療の評価を計算機上で完了させることができると考えています.
さらには,新規レーザーデバイスの設計や新治療法の開発に繋がることが期待されています!
おわりに
いかがだったでしょうか?
新規レーザーデバイスによる治療の安全性・有効性を科学的根拠に基づいて評価し,迅速に臨床へ橋渡しするというTranslational Researchについて紹介しました.
医学・光学・情報学・バイオという多岐に渡る学問分野を扱うのがこの研究の面白さの1つだと思います.
「自分の研究が従来の評価試験法を覆して,計算機臨床試験法の実用化に繋がるかもしれない」
「それによって,最先端の医療機器による治療・診断の評価が迅速化され,多くの人を救うことになるかもしれない」
そう考えると,結構すごいことをしているのかもしれないという気がしてワクワクしませんか?
私の研究は,従来の試験を計算機シミュレーションで置き換えるというチャレンジングなものだと認識しています.
未解明なことが多く苦労の連続ですが,だからこそ自分が世界初を成し遂げてやるという矜持をもって臨んでいます.
この記事を通じて,読者の方が医工学やレーザーに少しでも興味・関心を持っていただければ幸いです.
最後までお読みいただきありがとうございました!
質問・感想・研究室訪問等のお問合せは以下のアドレスまでお願いします!
Email: shimojo-y(at)mb.see.eng.osaka-u.ac.jp
大阪大学大学院 工学研究科 量子ビーム応用工学領域 粟津研究室
URL: http://www.see.eng.osaka-u.ac.jp/seemb/seemb/
参考文献
- Y. Shimojo, T. Nishimura, H. Hazama, N. Ito, K. Awazu. In silico Evaluation of Thermal Skin Damage Caused by Picosecond Laser Irradiation, in the Biophotonics Congress: Optics in the Life Sciences Congress 2019.
- T.M. Morrison, P. Pathmanathan, M. Adwan, E. Margerrison. Advancing regulatory science with computational modeling for medical devices at the FDA’s office of science and engineering laboratories, Front. Med. 2018; 5(241): 1-11.
- 粟津邦男. 次世代光医療ーレーザー技術の臨床への橋渡しー, シーエムシー出版 (2010).
- 粟津邦男. 赤外レーザー医工学, 大阪大学出版会 (2008).
- 加藤純二, 粟津邦男, 篠木毅, 守矢佳世子. 一からわかるレーザー歯科治療, 医歯薬出版株式会社 (2004).
- 堀内敏行. 光技術入門 [第2版], 東京電機大学出版局 (2014).